Por Leonardo Vieira R. Silveira
A febre reumática (FR) é uma complicação não supurativa da faringoamigdalite causada pelo estreptococo beta-hemolítico do grupo A (EBGA) – Streptococcus pyogenes – e decorre de resposta imune tardia (em geral, algumas semanas) a esta infecção em populações geneticamente predispostas.
Faringoamigdalite e impetigo são as infecções mais frequentemente causadas pelo EBGA, contudo somente a faringoamigdalite está relacionada à FR.
EPIDEMIOLOGIA
O EBGA é responsável por 15-20% das faringoamigdalites e pela quase totalidade daquelas de origem bacteriana. As viroses são responsáveis por aproximadamente 80% dos casos.
Estima-se que no Brasil ocorra anualmente cerca de 10 milhões de faringoamigdalites estreptocócicas, perfazendo um total de 30 mil novos casos de FR, dos quais aproximadamente 15 mil poderiam evoluir com acometimento cardíaco.
Na análise de morbidade, o cálculo do índice DALYs -disability-adjusted life years (anos potenciais de vida perdidos ajustados para incapacidade) – demonstrou o total de 55mil anos de vida perdidos em decorrência da FR, ou seja, 26 anos por paciente anualmente no Brasil, baseado em dados do ano 2000.
Para a ocorrência de FR não há predomínio de cor ou sexo, mas observa-se um pior prognóstico para o sexo feminino. Predomina na faixa etária dos 5 aos 15 anos, com apenas 20% dos casos acometendo adultos.
ETIOPATOGENIA
O desenvolvimento da FR está associado à infecção de orofaringe pelo EBGA, principalmente em crianças e adolescentes. Contribuem para o aparecimento da doença: fatores ambientais e socioeconômicos (alimentação inadequada, habitação em aglomerados e ausência ou carência de atendimento). Fatores genéticos de suscetibilidade à doença estão diretamente relacionados ao desenvolvimento da FR e suas sequelas.
Hoje se sabe, por estudos populacionais, que há uma associação da doença com os antígenos de classe II e que cada população tem seu próprio marcador (HLA-DR) para suscetibilidade à FR. É interessante notar que o alelo encontrado com mais frequência, independentemente da origem étnica, é o HLA-DR7. Esse achado, de diferentes marcados para cada população, é corroborado pela observação de que a incidência de FR após faringoamigdalite estreptocócica é praticamente a mesma em todo mundo (entre 1-5%), não variando em populações diferentes. É possível que diferentes cepas de estreptococos estejam envolvidas e que as diversas moléculas HLA de classe II reconheçam peptídeos antigênicos diferentes. Outros marcadores genéticos associados ao desenvolvimento da FR e relacionados com a resposta inflamatória foram identificados, recentemente, por metodologias de biologia molecular, como alelos que codificam para a produção de proteínas pró-inflamatórias, como TNF-alfa e o alelo responsável pela deficiência na produção da lecitina ligadora da manose (MBL), que tem a função de eliminar a bactéria pela ativação do complemento na fase inicial da infecção.
DIAGNÓSTICO
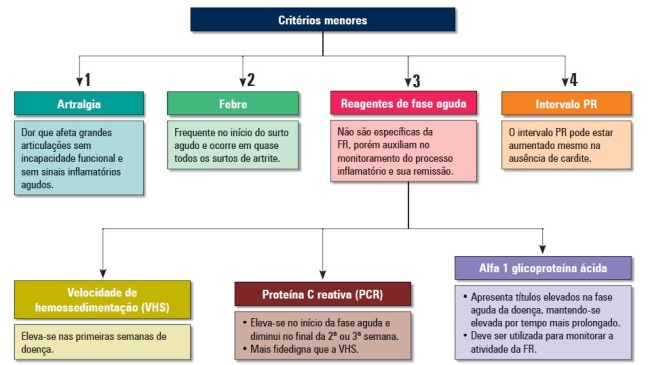
Atualmente, para diagnosticar o primeiro surto de FR utilizam-se os critérios de Jones modificados (Quadro 1) pela American Heart Association (AHA) em 1992 e/ou critérios de Jones revistos pela OMS em 2003 e publicados em 2004. Para o diagnóstico das recorrências de FR, há preferência pelos Critérios de Jones modificados pela OMS. De acordo com os critérios de Jones a probabilidade é alta quando há evidência de infecção estreptocócica anterior (elevação dos títulos da ASLO), além de pelo menos 2 critérios maiores (descritos posteriormente) ou 1 critério maior e 2 menores (Esquema 1).
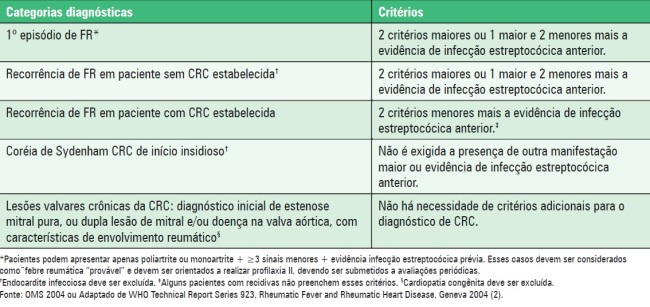
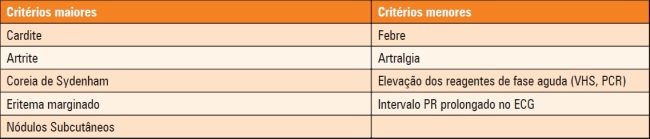
Quadro 2. Critérios da Organização Mundial de Saúde (2004) para o diagnóstico de 1º surto, recorrências e CRC (baseados nos critérios de Jones modificados).
Critérios Maiores
Cardite: manifestação mais grave, pois é a única que pode deixar sequelas e acarretar óbitos. Tem aparecimento precoce, em geral nas 3 primeiras semanas da fase aguda. E caracteriza-se por pancardite, com predomínio do envolvimento endocárdico.
Eritema Marginatum: é caracterizado por eritema com bordas nítidas, centro claro e contornos arredondados ou irregulares. Apresenta-se como lesões múltiplas, indolores, não pruriginosas, podendo haver fusão, resultando em aspecto serpiginoso. Sua ocorrência é rara, em menos de 3% dos pacientes.
Coreia de Sydenham (CS): é definida como desordem neurológica com movimentos rápidos involuntários e incoordenados, que desaparecem durante o sono e aumentam com estresse e esforço. Ocorre predominantemente em crianças e adolescentes do sexo feminino. Tem prevalência de 5 a 36%, e seu aparecimento costuma ser tardio (meses após infecção estreptocócica). O surto dura, em média, de 2 a 3 meses, e até 1 ano.
Artrite: edema na articulação ou associação da dor articular com a limitação dos movimentos. É a manifestação mais comum da FR (75% dos casos). É auto-limitada e não deixa sequelas. Sua forma típica é assimétrica e migratória.
Nódulos Subcutâneos: nódulos múltiplos, arredondados, de tamanhos variados (0,5 a 2cm), firmes, móveis, indolores e recobertos por pele normal, sem características inflamatórias. Localizam-se sobre proeminências e tendões extensores. Tem ocorrência rara, em 2 a 5% dos pacientes, muito associado à cardite grave. Seu aparecimento é tardio (1 a 2 semanas após as outras manifestações), regride rapidamente com o tratamento e raramente persiste por mais que 1 mês.
FISIOPATOLOGIA
Pelo que se conhece até hoje, a FR se dá a partir de um mecanismo de hipersensibilidade. Parece ocorrer uma reação cruzada entre a proteína M do Streptococcus pyogenes e as proteínas miosina, queratina e outras do tecido cardíaco humano. A reação inflamatória desencadeada em reação aos estreptococos induz uma inflamação no miocárdio e no endotélio da valva cardíaca. A lesão articular ocorre em decorrência de semelhança do ácido hialurônico do estreptococo com o ácido dos tecidos humanos, favorecendo a formação de anticorpos contra cartilagem das articulações. Anticorpos contra a membrana dos estreptococo atuam contra o citoplasma de neurônios localizados nos núcleos caudados e subtalâmico do cérebro causando a coreia de Sydenham .
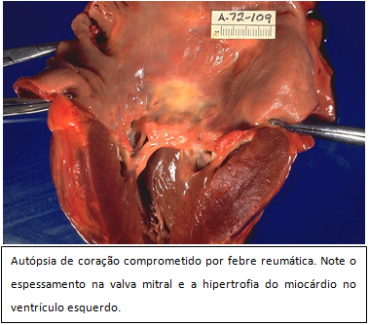
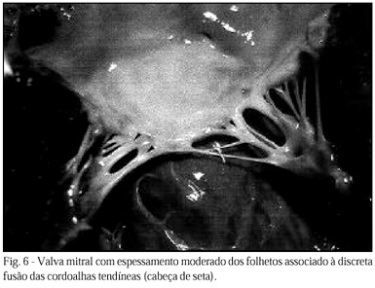
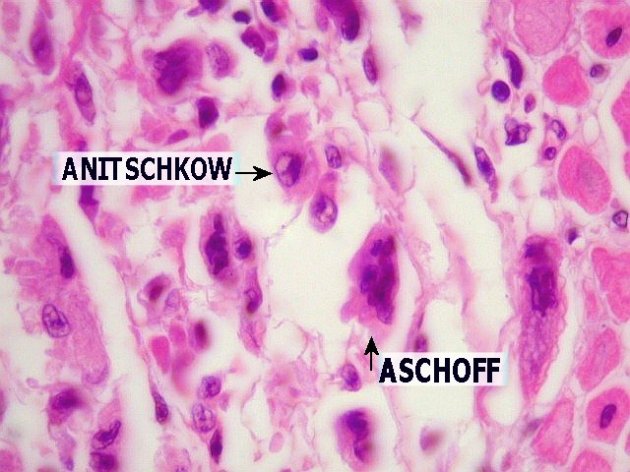
Na cardiopatia reumática, única lesão de longo prazo, inicialmente ocorrem lesões como a fragmentação das fibras colágenas, edema da substância intercelular, infiltração celular e degeneração fibrinoide. No coração, as lesões iniciais surgem nas valvas cardíacas sob a forma aparente de pequenas verrugas ao longo da linha de fechamento, podendo posteriormente, as valvas tornarem-se espessadas (Figura 1) e deformadas, com as cordoalhas encurtadas, resultando em estenose ou insuficiência valvar, podendo gerar sequelas como sopros, dilatação, arritmias e tromboembolismos. A valva mitral (Figura 2) é mais frequentemente envolvida, vindo a seguir a aórtica, a tricúspide, e, raramente a pulmonar. Pode ocorrer degeneração difusa e até necrose das células do miocárdio, com lesões inflamatórias perivasculares, formando os nódulos de Aschoff, que são formados por área central fibrinoide circundada por linfócitos, plasmócitos e grandes células basofílicas. Os nódulos subcutâneos se assemelham aos nódulos de Aschoff.
RESPOSTA IMUNE
O processo autoimune da FR foi determinado após estudos que observaram que as lesões no coração estava associadas a anticorpos e linfócitos do hospedeiro contra antígenos estreptocócicos que reconheciam tecido cardíaco por mimetismo molecular. A resposta mediada por linfócitos T parece ser especialmente importante em pacientes que desenvolvem cardite grave. Os anticorpos na FR são importantes durante sua fase inicial e, provavelmente, pelas manifestações de poliartrite e coreia de Sydenham.
Na cardite reumática, anticorpos reativos ao tecido cardíaco, por reação cruzada com antígeno do estreptococo, se fixam à parede do endotélio valvar e aumentam a expressão da molécula de adesão VCAM I, que atrai determinadas quimiocinas e favorecem a infiltração celular por neutrófilos, macrófagos e, principalmente, linfócitos T, gerando inflamação local, destruição tecidual e necrose.
Estudos histológicos de pacientes com cardite e cardite reumática crônica (CRC) mostraram células plasmáticas cercadas por linfócitos T CD4+ próximos a fibroblastos, sugerindo interação entre a célula plasmática (linfócito B) e o linfócito T. Os nódulos de Aschoff, considerados patognomônicos da doença e compostos por agregados de células semelhantes a macrófagos e monócitos, exercem a função de células apresentadoras de antígeno para as células T. Várias citocinas pró-inflamatórias são produzidas nas diversas fases evolutivas dos nódulos de Aschoff. Dessa forma, além da reação cruzada inicial, há apresentação continuada de antígenos no sítio da lesão, o que amplifica a resposta imune e a ativação de grande número de clones autorreativos de linfócitos T.
A produção de citocinas influencia de forma decisiva a resposta imune nos pacientes com FR. O número aumentado de linfócitos T CD4+ no sangue periférico de pacientes com cardite está ligado ao aumento de IL-1, TNF-alfa e IL-2 no soro. No tecido cardíaco de pacientes com cardiopatia reumática grave há predomínio de células mononucleares secretoras de TNF-α e IFN-ϒ (padrão Th1), enquanto raras células mononucleares infiltrantes das válvulas produzem IL-4 e citocina reguladora da resposta inflamatória. Portanto, a baixa produção de IL-4 está correlacionada com a progressão das lesões valvares na CRC, enquanto no miocárdio, onde há grande número de células produtoras de IL-4, ocorre cura da miocardite após algumas semanas.
Com base nesses dados, postula-se que a produção de citocinas direciona para uma resposta celular (Th1), causando quadros de cardite grave e sequela valvar e, provavelmente, para uma resposta predominantemente humoral (Th2), que causaria quadro clínico com coreia e atrite. Essa diferença de resposta é vista também na apresentação clínica, pois se observou que apenas 5% dos pacientes com cardite grave cursaram com coreia, enquanto a incidência entre os pacientes com cardite leve foi de 65%.
MORFOLOGIA DA CARDITE REUMÁTICA
- FASE AGUDA
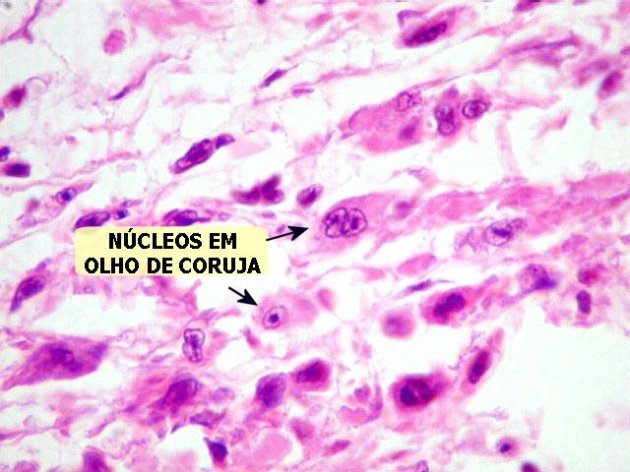
- Nódulos de Aschoff (Figura 3)– granuloma pelo processo inflamatório, com infiltrado de macrófagos ou Células de Antschkow (com cromatina condensada no centro do núcleo – “olhos de coruja” (Figura 4)), que formam sincícios. É patognomônico de cardite reumática. Microscopia dos nódulos: miócitos cardíacos e centro com exsutado formando nódulos com células miocárdicas mortas, linfócitos e fusões de macrófagos – Células de Antschkow (Firgura 3).
- Pericardite sero-fibrinosa (“pão com manteiga”) – secreta serina e fibrina, que tentem a se organizar.
- Necrose fibrinoide das cúspides e cordas tendíneas (válvulas destruídas pelo processo inflamatório > depósito de fibrina > forma verrucosidades > vegetações nas bordas valvares livres).
- Placa de MacCallum: lesões subendocárdicas > espessamento > zona de grande pressão na ejeção > turbilhonamento > área sofre espessamento e calcifica
- FASE CRÔNICA
- Quadro pode regredir totalmente, mas se os anticorpos antiestreptococos continuarem em níveis elevados, os efeitos permanecem.
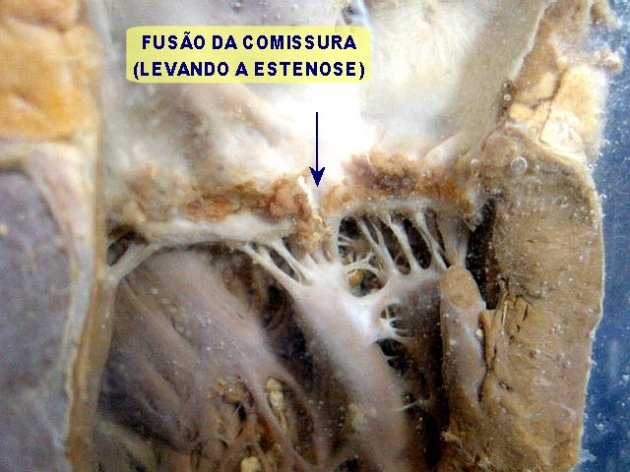
- Há organização e fibrose subsequente – espessamento dos folhetos valvares, fusão das comissuras valvares (duas cúspides se encontram – “casa de botão” ou “boca de peixe”), encurtamento e espessamento das cordas tendíneas (mitral e tricúspide). A retração das cordoalhas puxa a valva para baixo, em direção ao ventrículo, dando-lhe aspecto em funil (Figura 5).
BIBLIOGRAFIA
1. Peixoto A, Linhares L, Scherr P, Xavier R, Siqueira SL, Pacheco TJ,Venturinelli G. Febre Reumática: revisão sistemática. Rev Bras Clin Med. São Paulo, 2011 mai-jun;9(3):234-8
2. Spina GS. Doença reumática: negligenciada, mas ainda presente e mortal. Rev Med. São Paulo, 2008 abri-jun;87(2):128-41
3. Diretrizes Brasileiras para o diagnóstico, tratamento e prevenção da febre reumática. Arq Bras Cardiol 2009; 93(3 supl.4): 1-18
4. Barbosa PJB, Müller RE, Latado AL, Achutti AC, Ramos AIO, Weksler C, et al. Diretrizes Brasileiras para Diagnóstico, Tratamento e Prevenção da Febre Reumática da Sociedade Brasileira de Cardiologia, da Sociedade Brasileira de Pediatria e da Sociedade Brasileira de Reumatologia. Arq Bras Cardiol.2009;93(3 supl.4):1-18